انواع پیوندهای شیمیایی که ترکیبات مختلف را به وجود میآورند از نظر قدرت با یکدیگر متفاوت هستند و یکی از مهمترین مطالعاتی که باید روی آنها انجام دهیم، مقایسه قدرت پیوندهای شیمیایی است. از آنجا که در نبود پیوند شیمیایی هیچ مولکولی وجود نخواهد داشت، بررسی آنها از اهمیت بسیار زیادی برای دانشجویان رشته شیمی برخوردار است. در این مطلب از مجله فرادرس میخواهیم ابتدا انواع پیوندهای شیمیایی را معرفی کنیم و سپس به مقایسه قدرت پیوندهای شیمیایی بپردازیم. از جمله مهمترین پیوندهایی که در این مطلب به آن میپردازیم شامل پیوند کووالانسی، پیوند واندروالسی، پیوند هیدروژنی، پیوند فلزی و پیوند یونی هستند. در هر مورد نحوه تشکیل و ویژگیهای پیوند مربوطه را بررسی میکنیم و سپس به بررسی و مقایسه قدرت آنها با یکدیگر میپردازیم. در نهایت نیز برای محک آموختههای خود تعدادی مثال و تمرین چندگزینهای را بررسی خواهیم کرد.
مقایسه قدرت پیوندهای شیمیایی
مقایسه قدرت پیوندهای شیمیایی با توجه به ویژگیهایی که هر پیوند از خود نشان میدهد قابل انجام است. در شیمی ترکیبات به کمک پیوندهای متفاوتی در کنار تشکیل میشوند که در ادامه به فهرستی از این پیوندها اشاره کردهایم.
- پیوند کووالانسی
- پیوند واندروالسی
- پیوند هیدروژنی
- پیوند فلزی
- پیوند یونی
برای اینکه بتوانیم مقایسه قدرت پیوند های شیمیایی را انجام دهیم باید ابتدا با نحوه تشکیل و ویژگیهای هر پیوند آشنا شویم. در ادامه به این مورد خواهیم پرداخت.
انواع پیوندهای شیمیایی
یک «پیوند شیمیایی» (Chemical Bond) نیرو یا جادبهای است که بین اتمها و یونها در ترکیبات شیمیایی مشاهده میشود. این پیوند زمانی برقرار میشود که اتمها، الکترونهای لایه ظرفیت خود را به اشتراک بگذارند یا منتقل کنند. این الکترونها مربوط به لایه ظرفیت هستند که در بیرونیترین لایه هر عنصر قرار دارد. بنابراین پایه و اساس هر پیوند شیمیایی الکترونهای دخیل در آن است.
جابهجایی الکترون بین اتمها میتواند با رساندن آنها به قاعده اکتت باعث پایداری آنها شود و همین دلیل تشکیل پیوندهای شیمیایی است. برای نمونه مولکول رایجی مانند آب را در نظر بگیرید. این مولکول از یک اتم اکسیژن و دو اتم هیدروژن به وجود میآيد. هر اتم هیدروژن به اکسیژن یک الکترون میدهد و آن را به قاعده اکتت میرساند که در نتیجه پایداری به وجود میآيد.

پیوند کووالانسی
«پیوند کووالانسی» (Covalence Bond) نوعی نیروی جاذبه است که دو اتم را کنار یکدیگر قرار میدهد. این دو اتم یک زوجالکترون لایه ظرفیت را با یکدیگر به اشتراک گذاشتهاند. برای درک بهتر این نوع پیوند مثالی را مورد بررسی قرار میدهیم که به ورزش تنیس مربوط است.
در یک بازی تنیس دو نفر در دو سمت تور قرار دارند و توپ بین آنها در رفت و برگشت است و هر بازیکن برای دریافت توپ به سمت جلو حرکت میکند. میتوانیم هر بازیکن را به عنوان هسته یک اتم و توپ را به عنوان الکترون اشتراکی در نظر بگیریم. در این صورت حرکت توپ به سمت جلو و عقب را میتوان مانند پیوند کووالانسی بین آن دو در نظر گرفت.
بنابراین میتوانیم اینطور جمعبندی کنیم که الکترونهای اشتراکی بین هسته دو اتم در حال رفت و برگشت هستند. این اشتراکگذاری باعث به وجود آمدن مولکولی میشود که از دو یا تعداد بیشتری اتم تشکیل شده است. این نوع پیوند تنها بین اتمهای نافلزها برقرار میشود.
انواع پیوند کووالانسی
دو اتمی که توسط پیوند کووالانسی در کنار یکدیگر قرار دارند، میتوانند از یک عنصر باشند یا به دو عنصر متفاوت تعلق داشته باشند. زمانی که دو اتم درگیر در پیوند کووالانسی از دو نوع متفاوت باشند، ترکیبی به وجود میآید که آن را با نام «ترکیب کووالانسی» (Covalent Compound) میشناسیم. برای مثال آب نمونهای از یک ترکیب کووالانسی است. به تصویر زیر توجه کنید که نحوه اشتراکگذاری الکترونها را به خوبی نشان داده است.

حال میخواهیم بدانیم اتم اکسیژن با هر اتم هیدروژن چند الکترون را به اشتراک گذاشته است. همانطور که مشاهده میکنید بین اکسيژن و هر اتم هیدروژن یک زوجالکترون وجود دارد که اشتراکی است. هر زوجالکترون در این تصویر نماینده یک پیوند کووالانسی است، بنابراین در کل در یک مولکول آب دو پیوند کووالانسی وجود دارد.
همچنین در تصویر زیر شاهد نوع دیگری از پیوند کووالانسی هستیم که بین دو اتم یکسان تشکیل میشود. در این تصویر دو اتم اکسیژن توسط پیوند کووالانسی به یکدیگر وصل شدهاند و مولکول کووالانسی را به وجود آوردهاند. به این نوع مولکول «مولکول دواتمی» (Diatomic Molecule) گفته میشود و مولکولهای کلر، برم و نیتروژن نمونههای رایجی از این نوع مولکول هستند.

همانطور که در تصویر بالا مشاهده میکنید این دو اتم، دو زوجالکترون را با یکدیگر به اشتراک میگذارند، بنابراین مولکول اکسیژن از دو پیوند کووالانسی تشکیل میشود.
علت تشکیل پیوند کووالانسی
دلیل تشکیل پیوند کووالانسی این است که اتمهای درگیر در آن با تشکیل پیوند کووالانسی به پایداری بیشتری میرسند. برای مثال به پیوند کووالانسی بین دو اتم اکسيژن در تصویر بالا توجه کنید. هر اتم اکسيژن بهصورت تنهایی دارای ۶ الکترون در لایه ظرفیت خود است. با تشکیل پیوند کووالانسی هر اتم اکسیژن دو الکترون خود را به اشتراک میگذارد و در این صورت تعداد الکترونهای ظرفیت اکسیژن در پیوند برابر با ۸ خواهد بود.
با داشتن ۸ الکترون، قاعده اکتت در آنها رعایت میشود و به پایداری میرسند. توجه داشته باشید که الکترونهای اشتراکی به هر دو هسته متصل هستند و همین نیرو است که دو اتم را کنار یکدیگر نگه میدارد و باعث تشکیل مولکول میشود.
انرژی پیوند کووالانسی چیست؟
تشکیل پیوند شیمیایی به کاهش انرژی پتانسیلی مولکول میانجامد. متعاقبا شکستن همین پیوند نیازمند مقداری انرژی است که آن را با نام «انرژی پیوند» (Bond Energy) میشناسیم. در این بخش میخواهیم به مقایسه قدرت پیوندهای شیمیایی از نوع کووالانسی بپردازیم. هرچه مقدار انرژی پیوندی بیشتر باشد به این معناست که پیوند قوی است و مولکول شامل پیوندهایی است که واکنشپذیری بسیار کمی از خود نشان میدهند.
مقایسه قدرت پیوند کووالانسی
هر چه مولکولی واکنشپذیری بالاتری داشته باشد، مقدار انرژی پیوند آن کمتر خواهد بود. در جدول زیر به مقایسه قدرت پیوندهای شیمیایی در اتمهای مختلف پرداختهایم.
| نوع پیوند شیمیایی | انرژی پیوند بر حسب کیلوژول بر مول |
| $$H-H$$ | ۴۳۶ |
| $$C-H$$ | ۴۱۴ |
| $$C-C$$ | ۳۴۷ |
| $$ {C=C} $$ | ۶۲۰ |
| $$ {C equiv C} $$ | ۸۱۲ |
| $$F-F$$ | ۱۵۷ |
| $$Cl-Cl$$ | ۲۴۳ |
| $$Br-Br$$ | ۱۹۳ |
| $$I-I$$ | ۱۵۱ |
| $$ {N equiv N} $$ | ۹۴۱ |
تمامی هالوژنها بهصورت طبیعی به شکل مولکول دواتمی وجود دارند و به دلیل واکنشپذیری بالایی که دارند، مقدار انرژی پیوند آنها کم است. نکته دیگری که در جدول بالا به چشم میآید تفاوت انرژی پیوند در پیوندهای کربن با مرتبه متفاوت است.
مقایسه قدرت پیوند کووالانسی با مرتبههای مختلف
همانطور که مشاهده میکنید پیوند کربن کربن دوگانه از پیوند کربن کربن یگانه قویتر است. به همین صورت پیوند سهگانه نیز از پیوند دوگانه استحکام بیشتری از خود به نمایش میگذارد. همچنین وجود پیوند سهگانه بین دو اتم نیتروژن، از واکنشپذیری آن بسیار میکاهد.
پیوند داتیو
پیوند «داتیو» (Dative) که با نام «کوئوردیناسیونی» (Coordinate) نیز شناخته میشود نوعی از پیوند کووالانسی است که در آن هر دو الکترون اشتراکی برای تشکیل پیوند شیمیایی از یک اتم تامین میشوند. از آنجا که این جفت الکترون توسط هر دو هسته جذب میشود، پیوندی بین آن دو شکل میگیرد.
برای درک بهتر تفاوت پیوند داتیو با پیوند کووالانسی متداول مثالی را مورد بررسی قرار میدهیم. واکنش زیر بین آمونیاک و هیدروژن کلرید صورت میگیرد و به تولید آمونیوم کلرید میانجامد.
$$ {NH_3 (g) + HCl (g) rightarrow NH_4Cl (s)} nonumber $$
يونهای آمونیوم با فرمول شیمیایی $$NH_4^+$$ از انتقال یک یون هیدروژن از هیدروژن کلرید به زوجالکترون روی مولکول آمونیاک به وجود میآيد. برای درک بهتر این انتقال به تصویر زیر توجه کنید.

زمانی که یون آمونیوم تشکیل میشود، چهارمین هیدروژن آن توسط پیوند داتیو به آن وصل خواهد شد زیرا هسته هیدروژن از کلر به نیتروژن منتقل شده است. الکترون این هیدروژن روی کلر باقی میماند و یون کلرید را به وجود میآورد. توجه داشته باشید که پس از تشکیل یون آمونیوم نمیتوان داتیو بودن پیوند آن را تشخیص داد و مانند دیگر پیوندهای کووالانسی است.
تنها تفاوتی که وجود دارد این است که برای ایجاد تمایز از روش متفاوتی برای نمایش پیوندهای داتیو در مقایسه با پیوند کووالانسی استفاده میشود. برای مثال به تصویر زیر توجه کنید که در آن یکی از پیوندها داتیو است و با فلش نشان داده شده است.

در ادامه مثال دیگری را بررسی میکنیم که مربوط به واکنش بین آمونیاک و بور تریفلوئورید است. همانطور که در تصویر زیر مشاهده میکنید بور در اطراف خود تنها ۳ زوجالکترون دارد و به اصطلاح مولکول $$BF_3$$ کمبود الکترون دارد. از زوجلکترون تنهای روی نیتروژن مولکول آمونیاک برای غلبه به این کمبود استفاده میشوند و محصولی تولید میشود که دارای یک پیوند داتیو است.

در این صورت میتوان برای نمایش این پیوند داتیو از مدل زیر استفاده کرد. در مولکول سمت راست از مثبت و منفی برای نمایش پیوند داتیو بهره گرفته شده است. سمت نیتروژن در این تشکیل پیوند دارای جزئی بار مثبت و سر دیگر دارای جزئی بار منفی خواهد بود. توجه داشته باشید که استفاده از این روش متداول نیست و بهتر است از فلش برای نشان دادن آن استفاده کنیم.

پیوند واندروالسی
«پیوند واندروالسی» که با نام «نیروی واندروالسی» (Van der Waals Forces) نیز شناخته میشود نوعی از برهمکنش بینمولکولی است که انواع متفاوتی دارد که در ادامه به دو مورد آن با بررسی جزئیات خواهیم پرداخت. این نیروی بینمولکولی اولین بار توسط شیمیدان هلندی «یوهان وان در والس» (Johannes van der Waals) شناسایی و معرفی شد.
نیروی دوقطبی دو قطبی
«نیروی دوقطبی دوقطبی» (Dipole Dipole Force) نوعی نیروی جاذبه است که بین مولکولهای قطبی وجود دارد. برای مثال به مولکول هیدروژن کلرید توجه کنید که در آن روی اتم هیدروژن بار جزئی مثبت و روی کلر بار جزئی منفی وجود دارد. در صورتی که چندین اتم هیدروژن کلرید در مجاورت یکدیگر قرار داشته باشند، بهصورتی جهتگیری میکنند که سر مولکول با بار الکتریکی مخالف در همسایگی یکدیگر قرار داشته باشد.

برای درک بهتر این مفهوم به تصویر زیر توجه کنید. نیروی دوقطبی دوقطبی در طبیعت شباهت زیادی به پیوند یونی دارد اما از آن بسیار ضعیفتر است.
نیروی پراکندگی لاندن
نیروی پراکندگی نوعی از نیروی واندروالسی در نظر گرفته میشود که ضعیفترین نوع آن نیز به شمار میرود. «نیروی پراکندگی لاندن» (London Dispersion Force) اولین بار در سال ۱۹۳۰ توسط «فریتز لاندن» (Fritz London) معرفی شد. این نیرو در نتیجه حرکات الکترونها در اتمها و مولکولهای ناقطبی به وجود میآید. برای درک بهتر این نیرو نمونهای را در ادامه مورد بررسی قرار میدهیم.
ابر الکترونی اتم هلیوم شامل دو عدد الکترون است که بهطور طبیعی انتظار داریم بهصورت متقارن و یکسان در اطراف هسته آن جای گرفته باشند با این حال در عمل چنین چیزی صدق نمیکند و عدم تقارن در پخش الکترون باعث به وجود آمدن دوقطبی لحظهای میشود. این دوقطبی ضعیف و موقت بر اتم هلیوم مجاور نیز از طریق نیروی جاذبه و دافعه الکتروستاتیک تاثیر میگذارد و باعث به وجود آمدن دوقطبی القایی میشود. به تصویر زیر در این رابطه توجه کنید.

این دوقطبیهای لحظهای و القایی با جاذبهای ضعیف به یکدیگر متصل میشوند. مقدار نیروی پراکندگی لاندن با افزایش تعداد الکترونها در اتمها یا مولکولها ناقطبی افزایش مییابد.
پیوند هیدروژنی
«پیوند هیدروژنی» (Hydrogen Bond) که پیشتر در مجله فرادرس راجع به آن صحبت کردیم، در واقع نوعی برهمکنش دوقطبی دوقطبی قوی است. با این حال همچنان از پیوند یونی و پیوند کووالانسی که بهصورت بینمولکولی برقرار میشوند، قدرت کمتری دارد اما از دیگر برهمکنشهای دوقطبی دوقطبی قویتر به شمار میرود.
برای تشکیل پیوند هیدروژنی باید دو مورد وجود داشته باشد که در زیر به آنها اشاره کردهایم.
- «دهنده پیوند هیدروژنی» (Hydrogen Bond Donor): یک مولکول که در آن اتم هیدروژن به اتمی با الکترونگاتیوی بالا، مانند نیتروژن، اکسیژن و فلوئور متصل باشد.
- «گیرنده پیوند هیدروژنی» (Hydrogen Bond Acceptor): یک مولکول که در آن روی اتمهای کوچک الکترونگاتیوی مانند نیتروژن، اکسیژن و فلوئور زوجالکترون تنها وجود داشته باشد.
اتمهایی با الکترونگاتیوی بالا مانند نیتروژن، اکسیژن و فلوئور توانایی حذف الکترونهای ظرفیت اتم هیدروژن را ندارد و در نتیجه از هیدروژن یون به وجود نمیآید. اتفاقی که در این پیوند صورت میگیرد این است که اتمهای الکترونگاتیو در مجاورت هیدروژن، الکترون لایه ظرفیت آن را به سمت خود میکشند و به اصطلاح پروتون آن را ناپوشیده میکنند و این باعث به وجود آمدن بار مثبت در سطح بسیار کوچکی میشود.
در این صورت اتم با الکترونگاتیوی بالا دارای بار منفی روی خود میشود و به شدت به اتم هیدروژن با بار سطحی مثبت جذب میشود. با انجام این مرحله شاهد تشکیل پیوند هیدروژنی خواهیم بود. توجه داشته باشید که به دلیل کوچک بودن اتم هیدروژن، این دو اتم میتوانند در فاصله بسیار نزدیکی از یکدیگر قرار بگیرند و این بر شدت پیوند هیدروژنی میافزاید.
پیوند هیدروژنی در آب
یکی از متداولترین پیوندهای هیدروژنی که در مولکولها مشاهده میشود مربوط به آب است. در صورتی که آب در حالت مایع باشد، پیوند هیدروژنی مدام تشکیل میشود و از بین میرود زیرا ذرهها در این حالت متحرک هستند. به تصویر زیر که مربوط به تشکیل پیوند هیدروژنی در آب است توجه کنید. همانطور که مشاهده میکنید در این مولکول دو نوع پیوند هیدروژنی وجود دارد.

یکی از این پیوندها، پیوند هیدروژنی درونمولکولی است که طول پیوند برابر با ۱٫۰۱ آنگستروم دارد. پیوند هیدروژنی دیگری که در آب مشاهده میشود، پیوند هیدروژنی بینمولکولی نام دارد و طول پیوند آن برابر با ۱٫۷۵ آنگستروم است. آب دارای دو زوجالکترون و دو اتم هیدروژن است که به اتم اکسیژن با الکترونگاتیوی بسیار بالا متصل هستند. به این صورت هر ۱ مولکول آب میتواند تا ۴ پیوند هیدروژنی را نیز تشکیل دهد که در دوتای آنها نقش گیرنده پیوند هیدروژنی و در دوتای دیگر نقش پذیره پیوند هیدروژنی را ایفا میکند.
به دلیل تشکیل این پیوندهای هیدروژنی، اکسیژن آن دارای هیبریداسیون بهصورت $$sp^3$$ و چهاروجهی است. به دلیل وجود تعداد بالای پیوند هیدروژنی در شبکه این مولکول فضای خالی زیادی وجود دارد و به به همین علت، یخ نسبت به آب چگالی کمتری از خود نشان میدهد. در تصویر زیر میتوانید شبکهای تشکیل شده از مولکولهای آب را مشاهده کنید.

شناور بودن یخ روی آب تاثیر بسیار زیادی بر حیات جانوران دریایی دارد زیرا با داشتن حفرههای بزرگ در شبکه خود نقش عایق را ایفا میکنند و از یخ زدن کامل آب دریاچه و اقیانوس جلوگیری میکنند. در صورتی که یخ دارای چگالی بیشتر از آب مایع بود، زیر آب فرو میرفت و کل آب دریاچه یخ میزد و این زندگی جانوران را به شدت تهدید میکرد.
پیوند فلزی
«پیوند فلزی» (Metallic Bond) نوعی از پیوند است که در بین اتمها فلزی مشاهده میشود و برای درک آن باید ابتدا با مفهوم «دریای الکترون» (Sea of Electron) آشنا شویم. دریای الکترون نخستین بار توسط «پائول درود» (Paul Drude) معرفی شد. این دانشمند فلزها را بهصورت ترکیبی از هسته اتمها در کنار یکدیگر و الکترونها در میان آنها مدلسازی کرد. یکی از مواردی که در آن با پیوندهای فلزی سروکار داریم سیمهای مسی و ورقههای آلومینیومی هستند.

فلزها بهطور معمول دارای نقطه ذوب و نقطه جوش بالایی هستند و این به دلیل پیوند مستحکم بین اتمهای آنهاست. حتی فلز نرمی مانند سدیم با نقطه ذوب ۹۷٫۸ درجه سانتیگراد نیز از عنصر نئون که گاز نجیب قبل از آن است، در دمای بسیار بالاتری ذوب میشود. آرایش الکترونی فلز سدیم را میتوان بهصورت زیر نمایش داد.
$$ 1s^2;2s^2;2p^6;3s^1 $$
زمانی که اتمهای سدیم در مجاورت یکدیگر قرار میگیرند، الکترون موجود در زیرلایه $$3s$$ از یک الکترون فضای خود را با الکترون اتم همسایه به اشتراک میگذارد و به این صورت یک اوربیتال مولکولی تشکیل خواهد شد. نحوه تشکیل پیوند فلزی شباهت بسیار زیادی با نحوه تشکیل پیوند کووالانسی دارد که پیش از این به آن پرداختیم.
تفاوت پیوند فلزی با پیوند کووالانسی در این است که در پیوند فلزی هر اتم سدیم با ۸ اتم سدیم دیگر در ارتباط است و اشتراکگذاری بین اتم مرکزی و اوربیتالهای $$3s$$ هر ۸ اتم دیگر صورت میگیرد. هر کدام از این ۸ اتم سدیم، خود با ۸ اتم سدیم در ارتباط هستند و این برای تمامی اتمهای این شبکه صدق میکند. تمامی اوربیتالهای $$3s$$ اتمهای سدیم در این شبکه با یکدیگر همپوشانی میکنند و اوربیتالهای مولکولی را به وجود میآورند که باعث به وجود آمدن تکهای از یک فلز میشود.

مانند آنچه در تصویر بالا مشاهده میکنید الکترونها میتوانند آزادانه بین اوربیتالهای مولکولی حرکت کنند و به این صورت هر الکترون از اتم والد خود جدا خواهد شد و به آنها اصطلاحا الکترون نامستقر میگویند. نیروی که باعث نگه داشته شدن اتمهای فلزی در کنار یکدیگر میشود جاذبه بین هسته مثبت و الکترونهای نامستقر است.
پیوند یونی
«پیوند یونی» (Ionic Bond) نوعی نیروی جاذبه است که یونهای مثبت و منفی را در کنار یکدیگر نگه میدارد. این پیوند زمانی تشکیل میشود که فلزها، الکترون(ها) خود را به عنصرهای نافلزی بدهند. در تصویر زیر به نمونهای از این نوع پیوند اشاره کردهایم.

همانطور که مشاهده میکنید یک اتم سدیم $$(Na)$$ یک الکترون خود را به کلر $$(Cl)$$ داده است. با از دست دادن ۱ الکترون، اتم سدیم تبدیل به یون میشود و از آنجا که تعداد پروتونهای آن از الکترونها بیشتر است و دارای ۱+ میشود. برای نشان دادن این یون از نماد $$Na^+$$ استفاده میشود.
از طرف دیگر کلر یک الکترون از سدیم میگیرد و تبدیل به یون کلر میشود. در این صورت تعداد الکترونهای آن بیشتر از پروتونها است و دارای ۱- خواهد بود. این یون کلرید نامیده میشود و آن را با نماد $$Cl^-$$ نمایش میدهیم.
بنابراین یون سدیم و کلرید دارای بارهای مشابه اما با علامت مخالف یکدیگر هستند. میدانید که بارهای مخالف یکدیگر را جذب میکنند. در این صورت این دو یون نیز به یکدیگر جذب میشوند و در این مرحله یک پیوند یونی مستحکم بین آنها شکل میگیرد. به ترکیباتی مانند سدیم کلرید که توسط یک پیوند یونی به وجود میآيند، «ترکیب یونی» (Ionic Compound) گفته میشود.
علت تشکیل پیوند یونی
در این بخش میخواهیم بدانیم پیوندهای یونی به چه دلیلی تشکیل میشوند. همانطور که پیشتر گفتیم پیوند یونی بین فلزها و نافلزها تشکیل میشود زیرا فلزهای تمایل به دادن الکترون و نافلزها تمایل به دریافت آن دارند.
برای مثال در ترکیب یونی سدیم کلرید، سدیم فلزی قلیایی است که به گروه اول جدول تناوبی عناصر تعلق دارد. این عنصر مانند باقی عنصرهای همگروه خود در لایه ظرفیت تنها ۱ الکترون دارد. یعنی در صورتی که ۱ الکترون از دست بدهد، لایه انرژی بیرونی آن پر خواهد شد و پایدارترین آرایش الکترونی را پیدا میکند.

حال به آنیون این پیوند توجه کنید که مربوط به یون کلرید است. کلر یک هالوژن است و به گروه ۱۷ جدول تناوبی تعلق دارد. این عنصر در لایه ظرفیت خود دارای ۷ الکترون است. یعنی با به دست آوردن تنها ۱ الکترون لایه بیرونی آن پر میشود و به پایداری میرسد. با توجه به نکات گفته شده، در صورتی که سدیم ۱ الکترون به کلر بدهد، پایداری هر دو افزایش پیدا میکند و یک پیوند یونی نیز تشکیل میشود.
مقایسه قدرت پیوندهای شیمیایی از نوع یونی
برای حذف الکترون لایه ظرفیت از یک اتم نیاز به صرف انرژی است زیرا باید بر جاذبه بین الکترونهای منفی و هسته مثبت غلبه کرد. مقدار انرژی مورد نیاز به نوع عنصر بستگی دارد. هرچه تعداد الکترونهای حذفشونده کمتر باشد مقدار انرژی مورد نیاز نیز کاهش پیدا میکند. به همین دلیل است که سدیم و دیگر فلزهای قلیایی میتوانند به سادگی تبدیل به کاتیون شوند.
در یک گروه برای حذف الکترون از اتمهای بزرگتر به انرژی کمتری نیاز است زیرا جاذبه هسته آن بر بیرونیترین لایه الکترونی، با افزایش فاصله کاهش پیدا میکند. برای مثال در عناصر گروه ۱ جدول تناوبی حذف یک الکترون از فرانسیم در انتهای گروه نسبت به لیتیوم در ابتدای گروه سادهتر صورت میگیرد.
عکس همین نکته در مورد تشکیل آنیون از عنصرها صدق میکند زیرا در فرآیند گرفتن الکترون مقداری انرژی آزاد میشود. از همین رو هالوژنها برای تبدیل شدن به یون، بیشترین مقدار انرژی را آزاد میکنند و این دلیل واکنشپذیری بسیار بالای آنهاست.
مقایسه قدرت انواع پیوندهای شیمیایی
حال که با انواع پیوندهای شیمیایی و ویژگیهای آنها آشنا شدیم، میخواهیم در این بخش مقایسه قدرت پیوند های شیمیایی را انجام دهیم.
مقایسه قدرت پیوند یونی و کووالانسی
پیوند یونی یکی از قویترین پیوندهایی است که میشناسیم. این پیوند به دلیل جاذبه بین کاتیونها و آنیونها به وجود میآید و به دلیل انتقال کامل الکترون در آن پیوندی بسیار قوی به شمار میرود زیرا جاذبه الکتروستاتیکی بین کاتیون و آنیون زیاد است و به همین دلیل شکستن پیوند یونی دشوار خواهد بود.
توجه داشته باشید که شرایط و اجزای شرکتکننده در یک پیوند تاثیر زیادی روی آن دارد اما بهطور کلی پیوند یونی قویترین پیوند شیمیایی در نظر گرفته میشود. برای مثال میدانیم که پیوند یونی بین کاتیون و آنیون با ۲ بار الکتریکی از پیوند یونی بین کاتیون و آنیون با ۱ بار الکتریکی قدرت بیشتری دارد.
مورد دیگر موثر بر قدرت پیوند یونی، شعاع یونی است. بهصورتی که هرچه یونی بزرگتر باشد، پیوند یونی حاصل از آن ضعیفتر خواهد بود زیرا فاصله دو هسته نسبت به یکدیگر با افزایش شعاع یون، افزایش پیدا میکند.

از طرفی در پیوند کووالانسی تنها اشتراکگذاری الکترونهای لایه ظرفیت صورت میگیرد و خبری از انتقال الکترون از اتم به اتم دیگر نیست. اشتراکگذاری الکترون باعث میشود هسته دو اتم به الکترون اشتراکی جذب شوند و پیوندی قوی از نوع کووالانسی به وجود خواهد آمد.
در پیوند کووالانسی امکان تشکیل پیوند دوگانه و سهگانه نیز وجود دارد و هرچه تعداد پیوند بین دو اتم بیشتری باشد، برای شکستن آن نیاز به انرژی بیشتری وجود دارد، یعنی پیوند قویتری است. در این صورت پیوند کووالانسی سهگانه از دوگانه و آن هم از یگانه قدرت بیشتری دارد.
بهطور کلی پیوندهای کووالانسی به دلیل به اشتراکگذاری الکترون نسبت به پیوند یونی به دلیل انتقال الکترون، قدرت کمتری دارند اما توجه داشته باشید که برخی پیوندهای یونی ضعیف از پیوندهای کووالانسی قدرت کمتری دارند و باید هر پیوند را مورد به مورد بررسی کرد.
مقایسه قدرت پیوند کووالانسی قطبی و پیوند کووالانسی ناقطبی
پیوندهای کووالانسی قطبی نسبت به پیوندهای کووالانسی ناقطبی از قدرت بیشتری برخوردار هستند. در صورتی پیوند کووالانسی قطبی خواهد بود که دو اتم درگیر در پیوند دارای اختلاف الکترونگاتیوی چشمگیری نسبت به یکدیگر باشند. تحت چنین شرایطی یکی از اتمها که الکترونگاتیوی بیشتری دارد، الکترون اشتراکی را به سمت خود میکشد و باعث قطبی شدن پیوند میشود.
میدانیم که بین گونههای باردار جاذبه الکتروستاتیکی با افزایش مقدار بار افزایش پیدا میکنید. به همین دلیل پیوند کووالانسی قطبی ویژگیهایی از پیوند یونی را دارد و از پیوند کووالانسی ناقطبی بسیار قویتر است.
مقایسه قدرت پیوندهای بین مولکولی
در این بخش میخواهیم به مقایسه قدرت پیوندهای بینمولکولی در شیمی بپردازیم که نوعی از برهمکنش بین مولکولها هستند. قویترین برهمکنش بینمولکولی از نوع نیروی یون دوقطبی است. قدرت این برهمکنش به دلیل وجود یون است که ویژگیهایی نزدیک به پیوند یونی به آن میدهد.

برهمکنش قوی دیگر از نوع دوقطبی دوقطبی است که دومین پیوند بینمولکولی قوی به حساب میآید. دوقطبیها ذرههایی هستند که در دو سمت آنها بار جزئی با علامت مخالف وجود دارد. تشکیل دوقطبیها به دلیل اختلاف الکترونگاتیوی و هندسه مولکول است. سر منفی یک دوقطبی به سر مثبت دو قطبی دیگر متصل میشود و به این صورت یک برهمکنش دوقطبی دوقطبی ایجاد میشود.
پیوند هیدروژنی نوعی از برهمکنش دوقطبی دوقطبی است و قویترین نوع آن نیز به شمار میرود. همانطور که پیشتر نیز گفتیم پیوند هیدروژنی بین یک اتم هیدروژن و اتم دومی با الکترونگاتیوی بالا مانند نیتروژن، اکسیژن و فلوئور تشکیل میشود.
نیروی پراکندگی ضعیفترین برهمکنش بینمولکولی به شمار میرود که به دلیل حرکات تصادفی الکترونها به وجود میآید. در مدلسازی مکانیک کوانتوم، توزیع یکسان الکترونها در اوربیتال نادر است و همین باعث به وجود آمدن دوقطبی لحظهای خواهد شد.
مثال و حل تمرین
حال که با انواع پیوندهای شیمیایی آشنا شدیم و به مقایسه قدرت پیوندهای شیمیایی با یکدیگر پرداختیم، میخواهیم در این بخش ابتدا تعدادی مثال را به همراه پاسخ تشریحی آنها بررسی کنیم و سپس به تعدادی تمرین چندگزینهای خواهیم پرداخت.
مثال
در این بخش به بررسی تعدادی مثال پیرامون مقایسه قدرت پیوندهای شیمیایی میپردازیم و در هر مورد پاسخ تشریحی آن را نیز مرور میکنیم. با توجه به این پاسخهای تشریحی میتوان به پرسشهای مشابه پاسخ داد.
مثال اول
با توجه به نکات گفته شده در مورد نحوه تشکیل پیوند فلزی، نقطه ذوب بالای منیزیم (۶۵۰ درجه سانتیگراد) را نسبت به سدیم (۹۷٫۷۹ درجه سانتیگراد) چگونه توجیه میکنید؟
پاسخ
ابتدا به آرایش الکترونی این دو عنصر فلزی توجه کنید.
$$ Na: 1s^2;2s^2;2p^6;3s^1 $$
$$ Mg: 1s^2;2s^2;2p^6;3s^2 $$
همانطور که مشاهده میکنید آرایش الکترونی سدیم به $$3s^1$$ ختم میشود اما در همین زیرلایه برای منیزیم دو الکترون وجود دارد و هر دو آنها نامستقر میشوند. در نتیجه به دلیل داشتن دو الکترون نامستقر در دریای الکترونی آن دو برابر سدیم الکترون وجود خواهد داشت. همچنین یونهای باقیمانده نیز دارای دو برابر بار مثبت نسبت به یونهای سدیم با یک بار مثبت هستند.
میدانیم که هرچه تعداد بارهای دو یون مخالف بیشتر باشد، جاذبه میان آن نیز بیشتر خواهد بود. بنابراین پیوند فلزی در عنصر سدیم نسبت به پیوند فلزی در عنصر منیزیم قدرت کمتری دارد. از طرفی هرچه قدرت پیوند فلزی بیشتر باشد، نقطه ذوب فلزها نیز افزایش پیدا میکند. بنابراین قابل درک است که نقطه ذوب منیزیم از سدیم مقدار بسیار بالاتری باشد.
مثال دوم
چند الکترون بین اتمهای کربن درگیر در پیوند کووالانسی در ترکیب اتین وجود دارد؟ ساختار لوویس این مولکول را میتوانید در زیر مشاهده کنید.

پاسخ
میدانیم که اتین سادهترین ساختار خانواده آلکینها است که از دو اتم کربن تشکیل میشود. مشخصه بارز آلکینها داشتن پیوند سهگانه بین دو کربن است. همانطور که میدانید هر پیوند نشاندهنده ۲ الکترون است. در این صورت الکترونهای اشتراکی در پیوند کووالانسی بین دو کربن در اتین برابر با ۶ عدد خواهد بود.
مثال سوم
در زیر ۴ مولکول شیمیایی مختلف را مشاهده میکنید. کدام یک از آنها دارای پیوند شیمیایی از نوع یونی است؟
$$CO$$ و $$Na_2O$$ و $$CO_2$$ و $$CCl_4$$
پاسخ
از بین ۴ مولکول بالا تنها سدیم اکسید با فرمول شیمیایی $$Na_2O$$ است که توسط پیوند یونی تشکیل میشود. به تصویر زیر توجه کنید که ساختار این مولکول را نشان میدهد.

همانطور که مشاهده میکنید در این مولکول دو کاتیون سدیم با بار ۱+ و یک آنیون اکسید با بار ۲- وجود دارد و اتصال این اتمها به یکدیگر به دلیل ماهیت اتمها بهصورت یونی است. اکسیژن برای رسیدن به آرایش الکترونی پایدار به ۲ الکترون نیاز دارد و از هر اتم سدیم یکی از آنها را دریافت میکند.
از طرفی سدیم ۱ الکترون بیشتر از گاز نجیب پیش از خود دارد. به همین دلیل تمایل دارد آن را اهدا کند تا به پایداری بیشتری برسد.
مثال چهارم
پیوندهای شیمیایی موجود در مولکول $$AlCl_3$$ را بررسی کنید. (این ماده در دمای ۱۸۰ درجه سانتیگراد تصعید میشود.)
پاسخ
با توجه به دمای مورد نیاز برای تصعید این ماده میتوان با اطمینان گفت که پیوندهای آن از نوع شیمیایی نیست زیرا جاذبه کاتیون و آنیون در ترکیب یونی به حدی زیاد است که برای شکستن آن به دمای بسیار بیشتری نیاز داریم، بنابراین احتمال پیوندهای آن کووالانسی است. میتوان برای نشان دادن پیوندهای آن از تصویر زیر استفاده کرد.

این مولکول نیز مانند $$BF_3$$ که پیشتر به آن پرداختیم، کمبود الکترون دارد.
مثال پنجم
در تصویر زیر ۱۲ مولکول متفاوت شیمیایی را مشاهده میکنید. با دقت به ساختار آنها به سوالات زیر پاسخ دهید.

کدام یک از مولکولها در تصویر بالا میتواند نقش گیرنده پیوند هیدروژنی را ایفا کند؟
پاسخ
میدانیم که گیرنده پیوند هیدروژنی مولکولی است که در آن روی اتمهای کوچک الکترونگاتیوی مانند نیتروژن، اکسیژن و فلوئور زوجالکترون تنها وجود داشته باشد. بنابراین در این تصویر مولکولهای $$A$$ و $$C$$ و $$F$$ و $$G$$ و $$K$$ و $$L$$ گیرنده پیوند هیدروژنی به شمار میروند.
کدام یک از مولکولها در تصویر بالا میتواند نقش دهنده پیوند هیدروژنی را ایفا کند؟
پاسخ
همانطور که پیشتر گفتیم دهنده پیوند هیدروژنی مولکولی است که در آن اتم هیدروژن به اتمی با الکترونگاتیوی بالا، مانند نیتروژن، اکسیژن و فلوئور متصل باشد. با توجه به این تعریف مولکولهای $$B$$ و $$D$$ و $$H$$ و $$J$$ میتوانند نقش دهنده پیوند هیدروژنی را داشته باشند.
کدام یک از مولکولها در تصویر بالا میتواند نقش گیرنده پیوند هیدروژنی را ایفا کند؟
پاسخ
در دو مولکول $$E$$ و $$I$$ نه اتم الکترونگاتیو دارای زوجالکترون تنها حضور دارد و نه هیدروژن متصل به یک اتم الکترونگاتیو، بنابراین امکان شرکت در پیوند هیدروژنی را نخواهند داشت.
مثال ششم
ساختارهای دارای پیوند یونی و پیوند فلزی چه تفاوتها و شباهتهایی با یکدیگر دارند؟
پاسخ
این دو نوع پیوند شیمیایی از برخی جهات شباهتهای زیادی دارند. در فهرست زیر به مهمترین تفاوتها و شباهتهای آنها اشاره کردهایم.
- ساختارهای ناشی از پیوند یونی و پیوند فلزی هر دو دارای شبکه هستند.
- تشکیل هر دو ساختار به نیروی جاذبه الکتروستاتیک قوی بین اتمهای دخیل بستگی دارد.
- مولکولهای دارای پیوند فلزی و پیوند یونی بهطور معمول نقطه ذوب بالایی دارند.
- هر دو ساختار در حالت مایع هادی هستند.
- مولکولهای ناشی از پیوند فلزی در حالت جامد نیز هادی هستند اما این در مورد مولکولهای ناشی از پیوند یونی صدق نمیکند.
- مولکولهای دارای پیوند یونی معمولا در آب حل میشوند اما مولکولهای دارای پیوند فلزی این انحلالپذیری را ندارند.
تمرین
در این بخش میخواهیم به تعدادی تمرین چندگزینهای پیرامون مقایسه قدرت پیوندهای شیمیایی بپردازیم.
تمرین اول
مولکول موجود در کدام یک از گزینههای زیر توانایی تشکیل پیوند هیدروژنی را دارد؟
تمرین دوم
در کدام یک از گزینههای زیر یک ترکیب کووالانسی وجود دارد؟
تمرین سوم
در زیر ۷ مولکول متفاوت را مشاهده میکنید. نوع آنها به ترتیب در کدام یک از گزینه های زیر بهصورت صحیح آورده شده است؟
$$CH_4$$ و $$Fe_2O_3$$ و $$KNO_3$$ و $$I_2$$ و $$C_4$$ و $$H_2O$$ و $$BeCl_4$$
یونی ، یونی، یونی، کووالانسی، کووالانسی، کووالانسی، کووالانسی
کووالانسی، یونی، کووالانسی، یونی ، کووالانسی، یونی، یونی
یونی، یونی، کووالانسی، کووالانسی، یونی، کووالانسی، کووالانسی
کووالانسی، یونی، یونی، کووالانسی، کووالانسی، کووالانسی، یونی
تمرین چهارم
کدام یک از گزینه های زیر بهترین توصیف برای واکنش زیر به شمار میرود؟
$$ mathrm{Na}_2 mathrm{CO}_3+mathrm{CaCl}_2 longrightarrow mathrm{CaCO}_3+2 mathrm{NaCl} $$
واکنشدهندهها و فرآوردهها ترکیبات یونی هستند.
واکنشدهندهها و فرآوردهها ترکیبات کووالانسی هستند.
واکنشدهندهها ترکیبات کووالانسی و فرآوردهها ترکیبات یونی هستند.
واکنشدهندهها ترکیبات یونی و فرآوردهها ترکیبات کووالانسی هستند.
تمرین پنجم
کدام یک از مولکولهای زیر پیوند هیدروژنی تشکیل میدهد؟
تمرین ششم
هرچه یک پیوند شیمیایی … باشد، برای شکستن آن به انرژی … نیاز است.
قویتر، بیشتری
ضعیفتر، بیشتری
تمرین هفتم
پیوند کووالانسی … نسبت به پیوند کووالانسی … از قدرت … برخوردار است.
ناقطبی، قطبی، بیشتری
قطبی، ناقطبی، کمتری
قطبی، ناقطبی، بیشتری
تمرین هشتم
کدام یک از گزینههای زیر در مورد مقایسه قدرت پیوندهای شیمیایی صحیح است؟
پیوند کووالانسی یگانه > پیوند کووالانسی دوگانه > پیوند کووالانسی سهگانه
پیوند کووالانسی سهگانه > پیوند کووالانسی دوگانه > پیوند کووالانسی یگانه
پیوند کووالانسی سهگانه > پیوند کووالانسی یگانه > پیوند کووالانسی دوگانه
پیوند کووالانسی دوگانه> پیوند کووالانسی سهگانه> پیوند کووالانسی یگانه
تمرین نهم
در صورتی که یک پیوند کووالانسی بین اتم نیتروژن با الکترونگاتیوی ۳ و اتم اکسیژن با الکترونگاتیوی ۳٫۵ برقرار شود، کدام یک از گزینههای زیر در مورد آن صدق میکند؟
این پیوند کووالانسی از نوع ناقطبی است.
این پیوند کووالانسی قطبی و در آن اتم اکسیژن دارای بار الکتریکی جزئی منفی است.
این پیوند کووالانسی قطبی و در آن اتم نیتروژن دارای بار الکتریکی جزئی منفی است.
این پیوند کووالانسی قطبی و در آن اتم اکسیژن دارای بار الکتریکی جزئی مثبت است.
تمرین دهم
کدام یک از گزینههای زیر در مورد پیوندهای کووالانسی صحیح است؟
فارغ از اتمهای شرکتکننده در این پیوند، طول پیوند همواره یکسان خواهد بود.
الکترونهای ظرفیت باید برای رسیدن به پایداری بهصورت مساوی بین اتمهای درگیر در پیوند به اشتراک گذاشته شود.
پیوند کووالانسی زمانی شکل میگیرد که هسته دو اتم یکدیگر را جذب کنند.
اتمهای درگیر در پیوند کووالانسی فاصله ایدهال برای کاهش نیروی الکتروستاتیکی بین خود را پیدا میکنند.
تمرین یازدهم
پیوند کووالانسی موجود در کدام یک از ترکیبات گزینههای زیر از نوع ناقطبی است؟
تمرین دوازدهم
تعداد پیوندهای کووالانسی قطبی در ترکیب $$CCl_4$$ برابر با … است.
تمرین سیزدهم
کدام یک از مولکولهای زیر بیشترین مقدار نقطه جوش را دارد؟
تمرین چهاردهم
نیروهای بینمولکولی نسبت به پیوندهای درونمولکولی … هستند.
دارای قدرت برابر
نمیتوان نظر قطعی داد.
تمرین پانزدهم
نوع پیوند شیمیایی بین $$B-F$$ در مولکول $$BF_3$$ در کدام یک از گزینههای زیر بهصورت صحیح آورده شده است؟
پیوند کووالانسی قطبی
پیوند کووالانسی قطبی
پیوند هیدروژنی
تمرین شانزدهم
هرچه تفاوت الکترونگاتیوی بین دو اتم متصل به یکدیگر بیشتر باشد، درصد … در پیوند آن بیشتر است.
ویژگی کووالانسی
به اشتراکگذاری الکترون
تمرین هفدهم
کدام یک از گزینههای زیر با توجه به مفهوم پیوند فلزی صحیح است؟
با افزایش تعداد الکترونهای لایه ظرفیت در اتم فلزی، نقطه ذوب فلز کاهش پیدا میکند.
با افزایش تعداد الکترونهای لایه ظرفیت در اتم فلزی، نقطه ذوب فلز افزایش پیدا میکند.
تعداد الکترونهای لایه ظرفیت در اتم فلزی تاثیری روی نقطه ذوب آن ندارد.
با کاهش تعداد الکترونهای لایه ظرفیت در اتم فلزی، نقطه ذوب فلز افزایش پیدا میکند.
تمرین هجدهم
در تصویر زیر شاهد یک … هستیم که نوعی از پیوند … است.
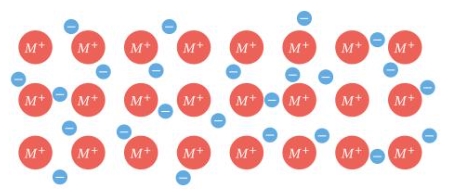
پیوند فلزی، فیزیکی
پیوند فلزی، شیمیایی
پیوند یونی، فیزیکی
پیوند یونی، شیمیایی
تمرین نوزدهم
بهطور کلی پیوند بین یک فلز و یک نافلز از نوع … است.
پیوند کووالانسی
پیوند واندروالسی
پیوند هیدروژنی
تمرین بیستم
در تشکیل پیوند شیمیایی، فلزها …
الکترون دریافت میکنند.
الکترون از دست میدهند.
پروتون دریافت میکنند.
پروتون از دست میدهند.
تمرین بیست و یکم
جاذبه الکتروستاتیکی بین چه گونههایی برقرار میشود؟
دو یون با باز مثبت
دو یون با بار منفی
دو اتم با بار الکتریکی مخالف یکدیگر
سوالات متداول
حال که مقایسه قدرت پیوندهای شیمیایی را انجام دادیم، میخواهیم در این بخش به تعدادی از مهمترین و پرتکرارترین سوالهای موجود پیرامون آن بپردازیم.
پیوند هیدروژنی چیست؟
پیوند هیدروژنی در واقع نوعی برهمکنش دوقطبی دوقطبی قوی است که بین یک گیرنده و یک پذیرنده پیوند هیدروژنی تشکیل میشود.
نیروی پراکندگی لاندن چیست؟
نیروی پراکندگی لاندن نوعی از پیوند واندروالسی است که در نتیجه حرکات الکترونها در اتمها و مولکولهای ناقطبی به وجود میآید.
پیوند کووالانسی چیست؟
پیوند کووالانسی نوعی نیروی جاذبه است که دو اتم را کنار یکدیگر قرار میدهد. این دو اتم یک زوجالکترون لایه ظرفیت را با یکدیگر به اشتراک گذاشتهاند.
پیوند یونی چیست؟
پیوند یونی نوعی نیروی جاذبه است که یونهای مثبت و منفی را در کنار یکدیگر نگه میدارد. این پیوند زمانی تشکیل میشود که فلزها الکترون خود را به عنصرهای نافلزی بدهند.
تفاوت پیوند داتیو و پیوند کووالانسی در چیست؟
در پیوند کووالانسی هر الکترون مورد نیاز برای تشکیل پیوند از یک اتم تشکیل میشود اما در پیوند داتیو که زیرمجموعهای از پیوند کووالانسی است، یکی از اتمهای درگیر در پیوند هر دو الکترون را تامین میکند.
نیروی دوقطبی دو قطبی چیست؟
نیروی دوقطبی دوقطبی نوعی نیروی جاذبه است که بین مولکولهای قطبی وجود دارد و زیرمجموعه پیوند واندروالسی به شمار میرود.
قویترین نیروی برهمکنش بینمولکولی کدام است؟
پیوند هیدروژنی قویترین نوع برهمکنش بینمولکولی است که برای تشکیل به دهنده پیوند هیدروژنی و گیرنده پیوند هیدروژنی نیاز دارد.
جمعبندی
هدف از این مطلب مجله فرادرس بررسی و مقایسه قدرت پیوندهای شیمیایی بود. در ابتدا به بررسی انواع پیوندهای شیمیایی از جمله پیوند کووالانسی، پیوند واندروالسی، پیوند هیدروژنی، پیوند فلزی و پیوند یونی پرداختیم و در هر مورد ویژگیها و نحوه تشکیل آنها را نیز مرور کردیم.
در ادامه قدرتی که این پیوندها از خود نشان میدهند را با یکدیگر مقایسه کردیم و سپس برای عمق بخشیدن به آموختههای خود تعدادی مثال را به همراه پاسخ تشریحی آوردیم. در نهایت نیز به مرور تعدادی تمرین چندگزینهای پیرامون مقایسه قدرت پیوندهای شیمیایی پرداختیم.
source